In che modo il monitoraggio del diaframma può aiutare a migliorare la ventilazione meccanica
Il supporto respiratorio è un intervento salvavita nell'unità di terapia intensiva, ma senza il giusto equilibrio aumenta anche il rischio di esiti dannosi.s.[1],[2] In questo, il monitoraggio del diaframma arriva in aiuto, perché funge da indicatore di esiti come la mortalità ospedaliera e lo svezzamento prolungato. Inoltre, può aiutare a prendere decisioni terapeutiche più consapevoli durante il trattamento respiratorio.
L'impatto clinico della lesione del diaframma
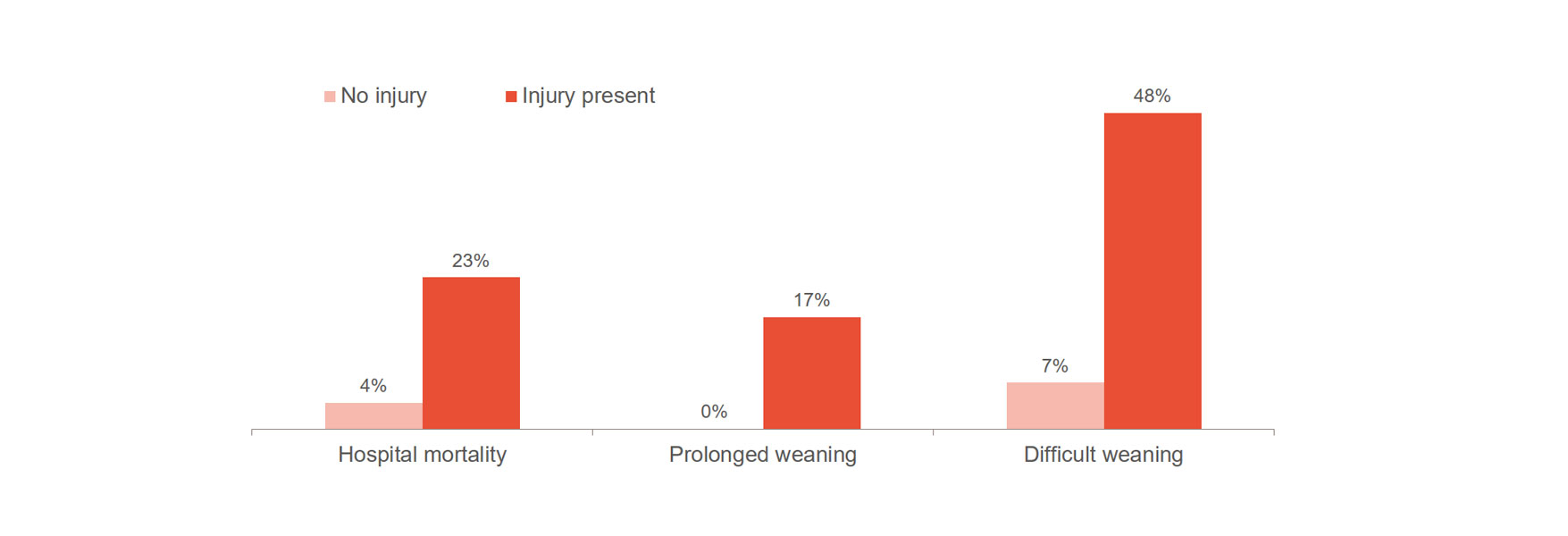
La lesione del diaframma aumenta significativamente il rischio di peggioramento degli esiti, ad esempio: difficoltà nello svezzamento, svezzamento prolungato e mortalità ospedaliera.[1],[2] È importante notare che il 23-84% dei pazienti presenta lesioni diaframmatiche significative durante la prima prova di respirazione spontanea. [3] Uno studio ha evidenziato un tempo medio di ventilazione di 576 ore per i pazienti con lesioni al diaframma, rispetto alle 203 ore per i pazienti senza lesioni.[4]
Si ritiene che le cause principali siano dovute a due fattori.[1] In alcuni casi, i pazienti compiono sforzi eccessivi per respirare, causando l'ispessimento del diaframma. In altri casi, i pazienti si sforzano poco a causa dell'eccessiva assistenza e/o della ventilazione controllata nelle prime fasi del trattamento, con conseguente atrofia. Entrambi i cambiamenti hanno peggiorato gli esiti e la problematica per i clinici di oggi è che gli strumenti diagnostici del ventilatore più diffusi non riescano ad acquisire queste informazioni.
Perché gli strumenti diagnostici dei ventilatori attuali non sono sufficienti
Le curve del ventilatore sono utilizzate per interpretare le esigenze respiratorie del paziente, ma la loro funzione principale è quella di mostrare ciò che si eroga. Ciò rende difficile rilevare asincronie, un'eccessiva sedazione o anche una sovra o sotto assistenza durante la respirazione spontanea.
Ad esempio, solo il 21% dei clinici rileva l'asincronia sotto forma di sforzi inspiratori mancati.[5] Inoltre, un paziente sottoposto a ventilazione con pressione assistita può in apparenza attivare respiri spontanei, che in realtà non sono stati attivati.[5], [6]
Il risultato è un'incertezza circa lo sforzo respiratorio esercitato dal paziente e su quanto il diaframma sia a rischio di lesioni.
Come monitorare il diaframma
Per cercare di proteggere il diaframma ed esercitarlo, è necessario diagnosticare la potenziale lesione e monitorare l'attività continua del diaframma.
Un'ecografia aiuta a valutare la disfunzione del diaframma misurandone lo spessore e le sue potenziali variazioni nel tempo. I recenti progressi nell'imaging ad ultrasuoni consentono ai clinici di valutare più facilmente la funzione del diaframma e di proteggerlo durante la ventilazione meccanica.[7]
Per il monitoraggio continuo, respiro dopo respiro, dell'attività diaframmatica è disponibile il monitoraggio dell'attività elettrica del diaframma (Edi). Si tratta di uno strumento diagnostico da posto letto ottenuto tramite un sondino di alimentazione appositamente progettato. Il segnale elettrico viene visualizzato come una forma d'onda accanto alle convenzionali curve di pressione/flusso del paziente e mostra la presenza, l'assenza e la forma del respiro.
Edi può aiutare a comprendere il lavoro respiratorio, rilevare le asincronie e valutare la misura in cui un'assistenza eccessiva o insufficiente e la sedazione influiscono sulla capacità respiratoria.[8],[9] È anche possibile rilevare cambiamenti nello sforzo in seguito agli interventi. Ad esempio quando si cambia la posizione del paziente, si somministrano farmaci come Salbutamolo o, soprattutto, quando si riduce il supporto ventilatorio durante lo svezzamento.
Verosimilmente, per ottenere un quadro completo, è necessario combinare il monitoraggio a ultrasuoni al monitoraggio continuo del diaframma (Edi).
Come il monitoraggio del diaframma può aiutare a proteggere il paziente e a semplificare lo svezzamento
Per non incorrere in lesioni polmonari indotte dalla ventilazione meccanica, si cerca di evitare la ventilazione invasiva, asincronie, un'eccessiva e/o insufficiente assistenza e lunghi periodi di sedazione e inattività del diaframma. I pazienti che "combattono con il ventilatore" spesso perdono. Da ciò può conseguire un aumento della sedazione, una ventilazione prolungata e infine un'eventuale intubazione.
Il monitoraggio del diaframma può aiutare a gestire tali problemi.[10],[11],[12] Mostra gli sforzi compiuti dal paziente, respiro dopo respiro. Inoltre, mostra se il ventilatore reagisce per tempo, con la quantità adatta di supporto, poiché costituisce un valore fisiologico obiettivo da usare come guida.
Nella terapia non invasiva, può aiutare ad adattare i tempi e il supporto del ventilatore, riducendo la necessità di intubazione. Una buona interazione paziente-ventilatore è uno dei fattori cardine per il successo della NIV.[13]
Il monitoraggio continuo può fungere da indicatore in tempo reale dello sforzo respiratorio, aiutando a capire quando l'intubazione sia davvero necessaria. Può persino aiutare a ottimizzare i tempi delle prove di respirazione spontanea e, molto spesso, a farle progredire con maggiore successo.
In che modo il monitoraggio del diaframma può aiutare a ridurre il tempo sul ventilatore
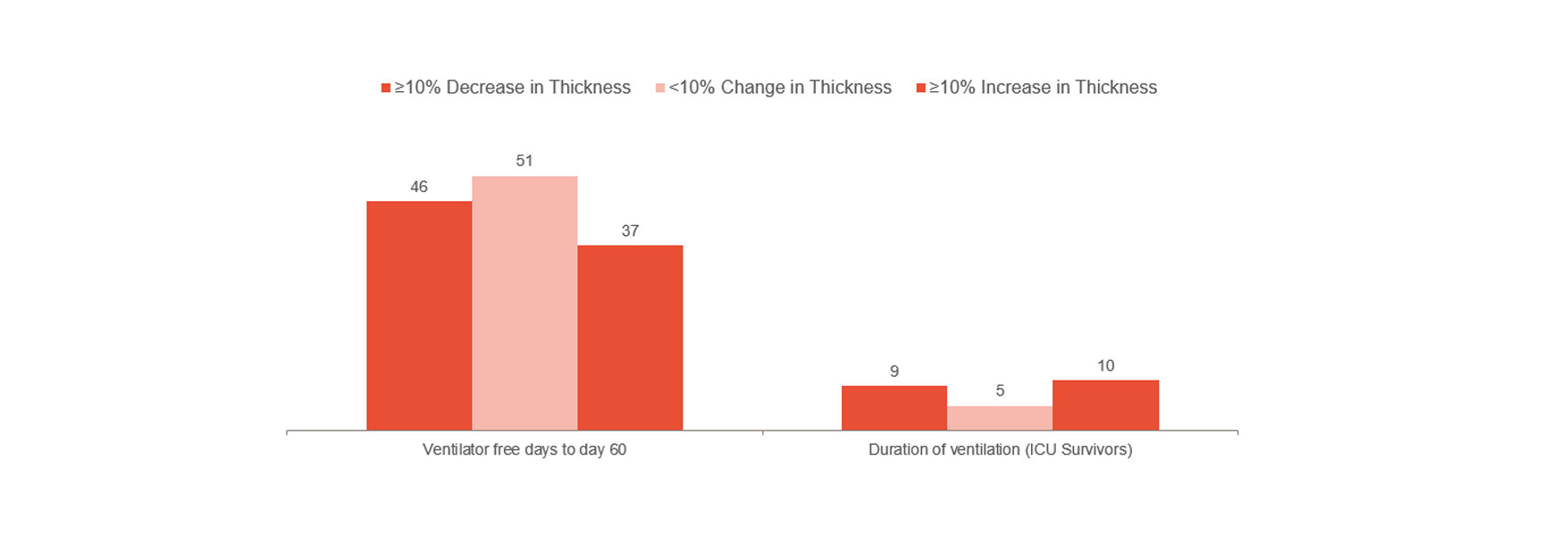
Goligher ha dimostrato che la variazione precoce dello spessore del diaframma era un indicatore della durata della degenza in terapia intensiva e di altre complicanze come la reintubazione, la tracheostomia, ventilazione meccanica prolungata e il decesso.[1] Goligher indica quindi che restare entro una frazione di ispessimento del 10-20% può essere il modo migliore per progredire. Pertanto, può fornire indicazioni sul rischio per il paziente e aiutare a ottimizzare il trattamento. Per comprendere ulteriormente se la prevenzione delle lesioni del diaframma può evitare complicanze sono necessari studi clinici randomizzati.
In linea con quanto sopra, tuttavia, è l'esperienza clinica di un ospedale londinese che ha indicato una significativa riduzione del tempo dedicato alla ventilazione meccanica durante il monitoraggio dell'attività del diaframma.[14] Il gruppo non monitorato aveva una media di 12 giorni sulla ventilazione meccanica rispetto a una media di 9 giorni per il gruppo monitorato (103 pazienti su 493).
Il monitoraggio del diaframma può anche aiutare a scoprire eventuali disturbi, come la sindrome da ipoventilazione centrale congenita e il danno al nervo frenico.[15],[16]
In che modo il monitoraggio del diaframma può aiutare a prendere decisioni di trattamento più consapevoli
Il monitoraggio dell'attività del diaframma può aiutarvi a prendere decisioni più informate per tutto il trattamento e a fornire informazioni preziose in diversi punti decisionali.
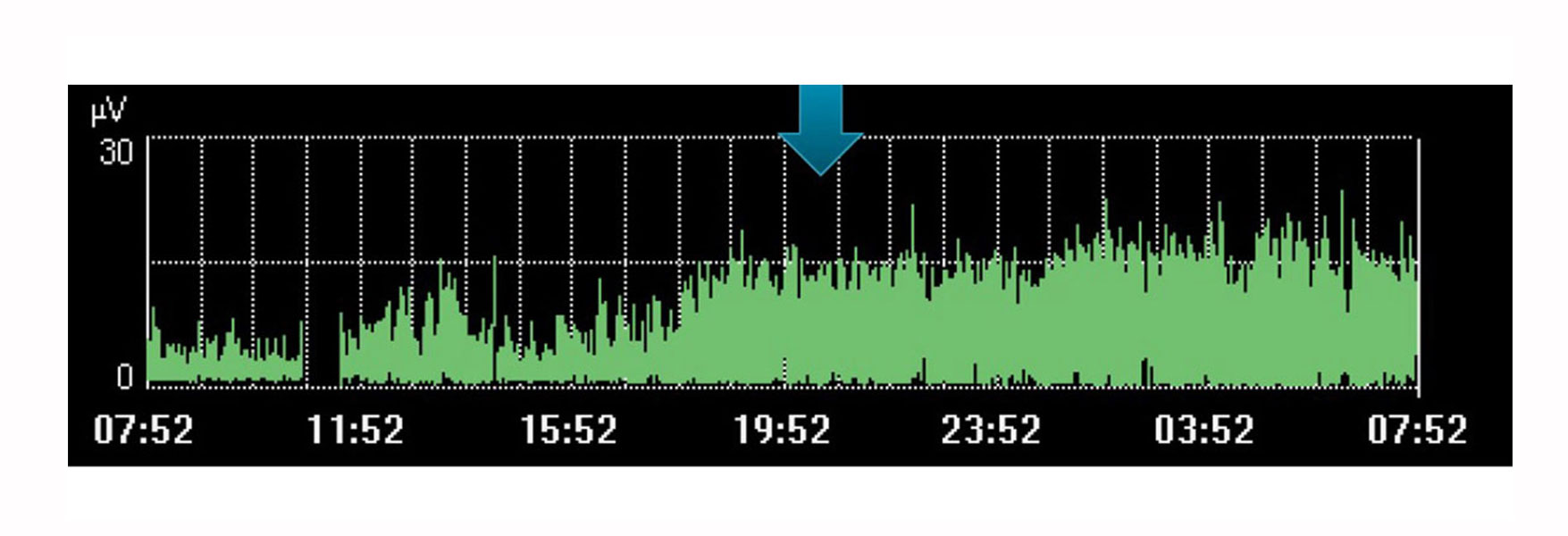
Monitoraggio e tendenza della respirazione
Report recenti indicano che il monitoraggio del diaframma con l'Edi è utile per il controllo dello sforzo respiratorio e dell'interazione paziente-ventilatore.[18]
Ovviamente il monitoraggio Edi, come singolo valore isolato, comporta delle limitazioni. Come altre variabili fisiologiche, deve essere valutato in combinazione con altre misurazioni e modifiche successive nell'ambito terapeutico. Questo è un trend che, nel tempo, può aiutare a determinare se il paziente sta andando verso la direzione desiderata.
Ad esempio, l'immagine riportata sopra mostra un aumento dello sforzo del diaframma in un periodo in cui il medico aveva pianificato un riposo per il paziente. Il trend indica che non c'è stato riposo, come evidenziato dal maggior sforzo del paziente durante questo periodo.
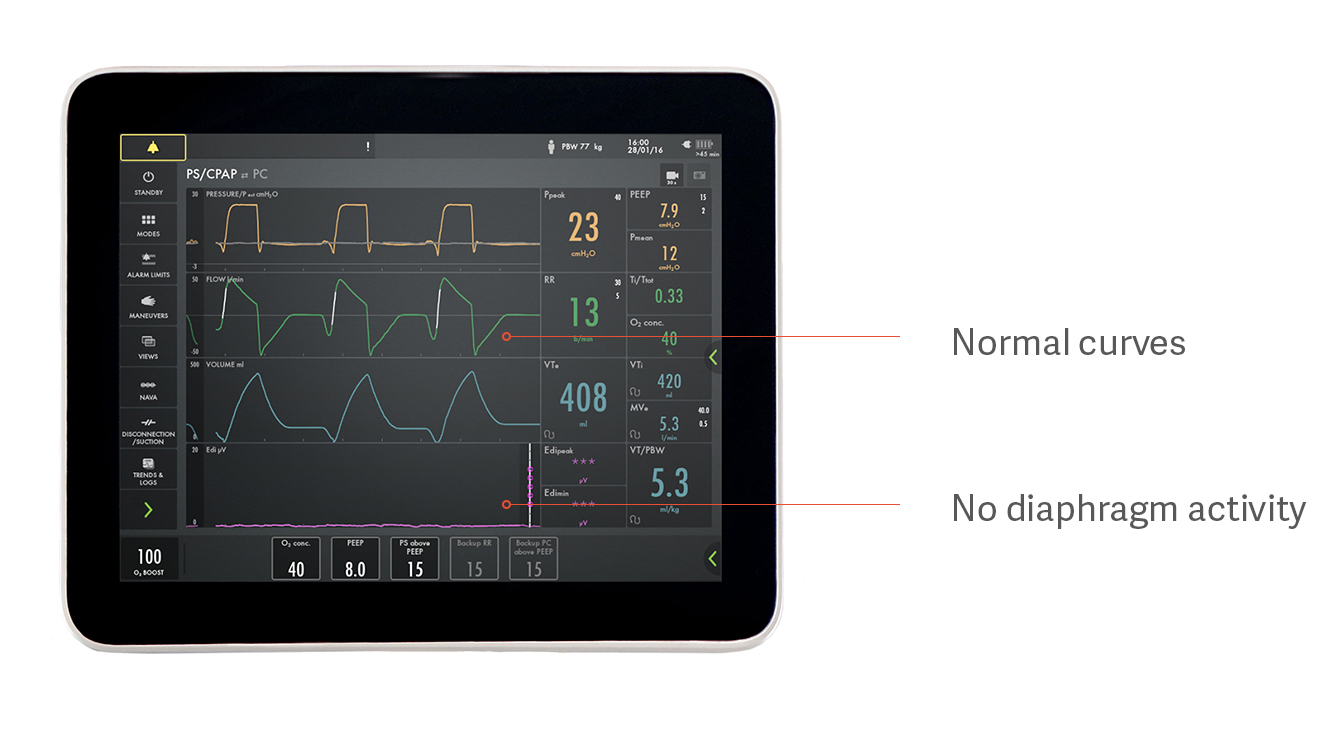
Identificazione di assistenza eccessiva o insufficiente
Per evitare lesioni al diaframma del paziente, il diaframma deve essere attivo a un livello appropriato. Questo è difficile da vedere senza il monitoraggio della membrana.
Ad esempio, un paziente può sembrare in grado di respirare spontaneamente con la pressione assistita, ma non utilizzare affatto il diaframma, come indicato nell'immagine sopra. Questo è un esempio di come la sovrassistenza impedisca il funzionamento del diaframma, con conseguente atrofia del diaframma. Le curve di pressione, flusso e volume appaiono normali, ma il segnale Edi viola nella parte inferiore è piatto, il che indica un diaframma inattivo.
Un altro esempio è l'assistenza insufficiente, che è l'opposto dell'assistenza eccessiva e altrettanto negativa per il paziente. Un paziente non assistito compie uno sforzo eccessivo nel respirare, con conseguente ispessimento del diaframma. È forse più facile da osservare nel paziente, ma senza un valore oggettivo sul ventilatore è difficile da sapere con certezza.
Entrambi gli esempi di lesioni del diaframma (atrofia e ispessimento) sono osservati di frequente nei pazienti e associati a peggioramenti degli esiti clinici. [1]
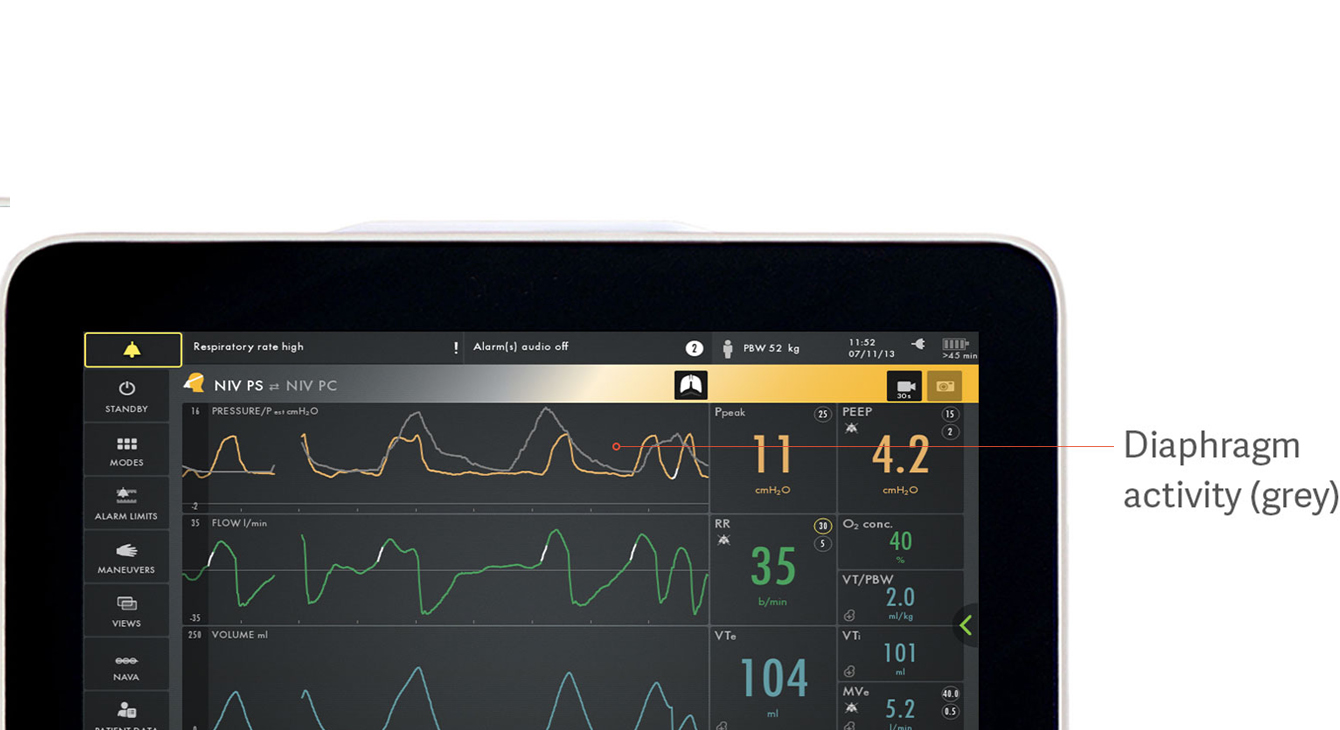
Identificare l'asincronia paziente-ventilatore
L'asincronia è associata a esiti clinici peggiori durante la ventilazione meccanica.[18] In un recente studio, solo il 21% dei clinici è riuscito a rilevare l'asincronia sotto forma di sforzi inspiratori mancati.[5] Esistono molti altri tipi di asincronie che vengono facilmente trascurate: sforzi inefficaci o eccessivi, sforzo inspiratorio ritardato, ciclo off ritardato, doppio trigger e auto-trigger.
L'immagine mostra in grigio l'attività elettrica del diaframma, sovrapposta alla curva di pressione (gialla), facilitando la visualizzazione delle differenze tra ciò che il paziente richiede e ciò che il ventilatore eroga.
Determinare la modalità di ventilazione
L'obiettivo dovrebbe essere che il paziente riesca a sostenere uno sforzo respiratorio ottimale che non sia né insufficiente, né eccessivo.[1] Monitorando continuamente l'attività del diaframma, si avrà un'indicazione di quanto e se il paziente si stia sforzando. Se l'attività del diaframma è elevata e in aumento, potrebbe essere necessario aumentare il livello di supporto.[19],[20],[21]
Se l'attività è bassa o ridotta, è possibile ridurre il livello di supporto.[19] È importante monitorare anche altri parametri diagnostici associati alla ventilazione prima di modificare il supporto. La ricerca sta facendo grandi passi in questo settore. In futuro, una maggiore conoscenza dei parametri del diaframma potrebbe migliorare ulteriormente la valutazione.[22]
Impostare una PEEP ottimale
Non esiste un modo standardizzato di impostare la PEEP del paziente durante la respirazione spontanea. Tuttavia, una PEEP ben impostata può ridurre l'atelettasia, l'apertura ciclica e la chiusura delle vie aeree e proteggere gli alveoli. Ciò, a sua volta, ottimizza la meccanica polmonare e migliora l'ossigenazione.
La titolazione PEEP con monitoraggio del diaframma ha mostrato risultati evidenti nei neonati, consentendo al bambino di rilassarsi adeguatamente tra un respiro e l'altro e prevenendo il dereclutamento dei polmoni.[12]
Nei pazienti adulti, Passath ha utilizzato il monitoraggio del diaframma e dell'ossigeno durante le variazioni della PEEP per consentire l'identificazione di un livello di PEEP a cui si verifica la respirazione corrente con il minimo sforzo.[23] Un abbassamento eccessivo della PEEP ha comportato un aumento del 50-60% del lavoro respiratorio che, in combinazione con il peggioramento dell'ossigeno, ha anche suggerito un dereclutamento polmonare parziale.
Ottimizzare la gestione della sedazione
Il principale vantaggio del monitoraggio dell'attività del diaframma in relazione alla sedazione è quello di cercare di mantenere il diaframma attivo il più possibile.[1] Basta semplicemente monitorare l'attività del diaframma del paziente e la risposta alla ventilazione per trovare un livello di sedazione adeguato con un'attività del diaframma sostenuta.
Potrebbe essere necessario un certo tipo di training per differenziare l'effetto della sedazione da altri tipi di effetti fisiologici che possono avere un impatto sulla funzione del diaframma; tuttavia, l'Edi è particolarmente efficace durante i periodi in cui il paziente non è sedato in quanto è possibile vedere continuamente il suo cambiamento di sforzo respiratorio.
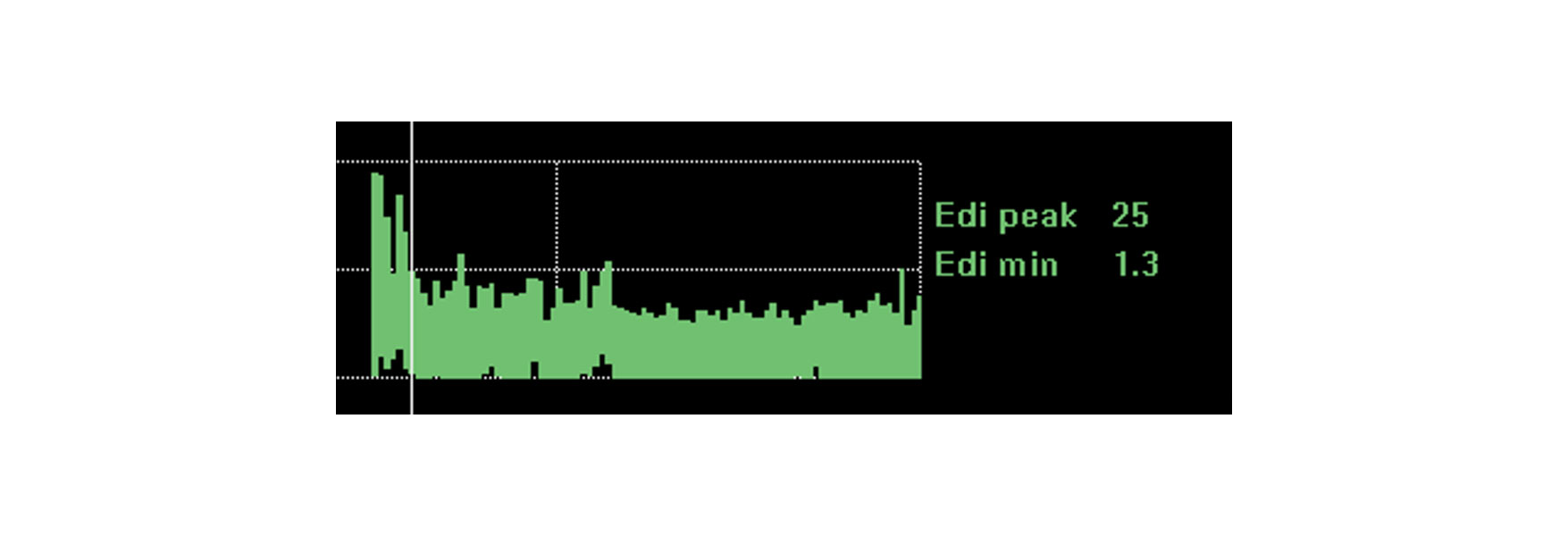
Tendenza e monitoraggio dell'impatto di interventi, riposo e riabilitazione
Il monitoraggio dell'attività del diaframma offre ulteriore rassicurazione sul fatto che il paziente possa affrontare i cambiamenti che si apportano. L'attività del diaframma è influenzata da una serie di cambiamenti fisiologici come il riposo, la posizione seduta, la deambulazione, il trattamento con caffeina e persino la riabilitazione e il recupero a livello generale.
Se il paziente affronta questi cambiamenti, l'attività del diaframma può rimanere in gran parte invariata. Un peggioramento della situazione clinica e la necessità di un maggiore lavoro respiratorio aumenteranno molto probabilmente l'attività del diaframma. Una migliore posizione di riposo ridurrà l'attività del diaframma necessaria per generare respiri.
L'immagine mostra l'attività del diaframma continua di un paziente che stava per essere intubato a causa di un disturbo respiratorio acuto in seguito a polmonite. Monitorando l'attività del diaframma, il medico è riuscito a ottimizzare il supporto e a invertire la situazione.
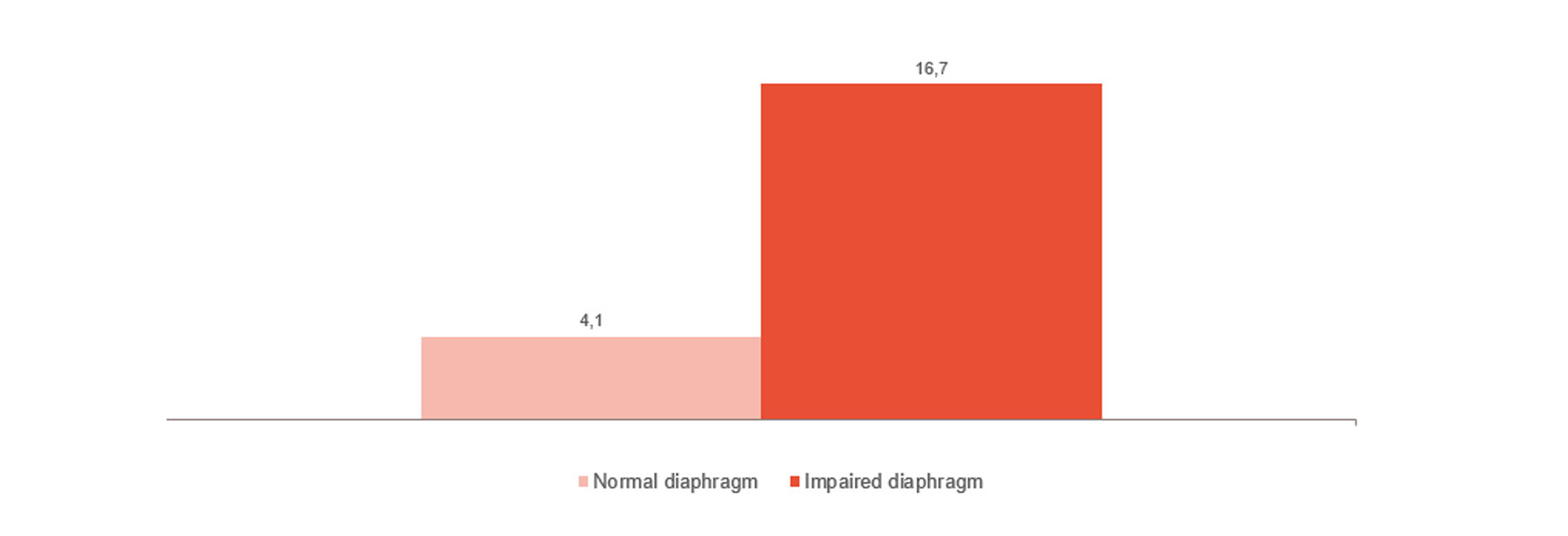
Monitoraggio e tendenza dello svezzamento
Come mostrato nell'immagine, la disfunzione del diaframma è strettamente correlata alle difficoltà di svezzamento.[4] Il monitoraggio dell'attività del diaframma può aiutare a capire se il paziente è pronto per lo svezzamento e a monitorarne il progresso,[24],[25],[26] partendo dalla ventilazione invasiva alla ventilazione non invasiva, alla terapia ad alti flussi, fino alla rimozione totale dei supporti.
La capacità del paziente di sostenere un supporto ridotto viene valutata in pochi minuti e può aiutare a intensificare o adeguare il supporto. Potrebbe essere necessario tornare alle impostazioni precedenti per evitare il rischio di recidività del paziente e le complicazioni che spesso ne derivano.
