Warum erweitertes hämodynamisches Monitoring?
Das Leben kritisch kranker Patient*innen mit hämodynamischer Instabilität hängt von der richtigen Entscheidung über den nächsten therapeutischen Schritt ab. Das erweiterte hämodynamische Monitoring hilft dabei, eine zielgerichtete und patienten-individuelle Therapie zu finden.
Das Monitoring physiologischer Parameter der Herz-Kreislauf-Funktion ist ein entscheidender Faktor für das zielgerichtete Management kritisch kranker Patient*innen.
Grenzen des Basismonitorings
Das Basismonitoring stößt bei hämodynamischer Instabilität aufgrund von Organversagen oder größeren Operationen an seine Grenzen. In solchen Fällen kann sich der Patientenstatus innerhalb kürzester Zeit rapide verändern. Für eine differenzierte Beurteilung der Kreislaufsituation, reichen die Standardparameter EKG, Blutdruckmessung und Pulsoxymetrie nicht mehr aus, um Herzzeitvolumen (HZV) und Sauerstofftransport für eine zielgerichtete, patienten-individuelle Therapie sicher einzuschätzen.
Differenziertere Beurteilung durch erweitertes hämodynamisches Monitoring
Das erweiterte hämodynamische Monitoring liefert zusätzliche und wesentlich präzisere Informationen über das Herz-Kreislauf-System wie Blutfluss, Volumenstatus, Gefäßtonus und kardiale Funktionen. Durch die kontinuierliche Überwachung und Analyse der Form und der Fläche unter der arteriellen Druckkurve (Pulskonturanalyse), der strukturellen und mechanischen Eigenschaften des Gefäßsystems und der physikalischen Eigenschaften des Blutes kann zu jeder Zeit eine differenzierte Beurteilung der Kreislaufsituation erfolgen und eine zielgerichtete Therapie eingeleitet werden.
Darüber hinaus ermöglicht der extravaskuläre Lungenwasserindex (ELWI) eine bettseitige Einschätzung von Lungenödemen, sodass frühzeitig eine therapeutische Intervention eingeleitet werden kann[1][2][3].
Prof. Dr. Bernd Christopher Saugel vom UKE Hamburg erklärt: „Während das hämodynamische Basismonitoring mit der Erfassung von Herzfrequenz, Blutdruck und weiteren Druckparametern im Wesentlichen die Funktion eines Sicherheitsmonitorings erfüllt, dient das erweiterte hämodynamische Monitoring dazu, Störungen der Homöostase aufzudecken, noch bevor die Vitalfunktionen beeinträchtigt werden." Nur auf Basis dieser erweiterten Parameter und spezieller Monitoring-Technologien ist eine gezielte Therapiesteuerung und somit ein hämodynamisches Management, möglich[4].
Das erweiterte hämodynamische Monitoring ermöglicht Antworten auf folgende Fragen:
- Wie ist die aktuelle kardiovaskuläre Situation?
- Wie ist die kardiale Vor- und Nachlast?
- Führt eine Erhöhung der Vorlast zu einem höheren HZV (reagiert der Patient auf Flüssigkeitsgabe)?
- Soll Volumen oder sollen Katecholamine verabreicht werden?
- Besteht das Risiko einer Volumenüberladung?
- Entwickelt der Patient ein Lungenödem?
Durch den Einsatz von erweitertem hämodynamischem Monitoring sind Ärzt*innen jederzeit über Veränderungen im Zustand des Patienten informiert. Dadurch kann die Behandlung sofort und zielgerichtet angepasst und eine patientenindividuelle Therapie unter optimaler Nutzung von Volumen, Inotropika und vasoaktiven Substanzen durchgeführt werden. Seit langem zeigen klinische Evidenzen, dass eine hämodynamische Optimierung im Rahmen einer zielgerichteten Therapie („Early Goal-Directed Therapy“, EGDT) Komplikationen und Morbidität reduziert, die Aufenthaltsdauer reduziert und Kosten einspart[5][6][7].
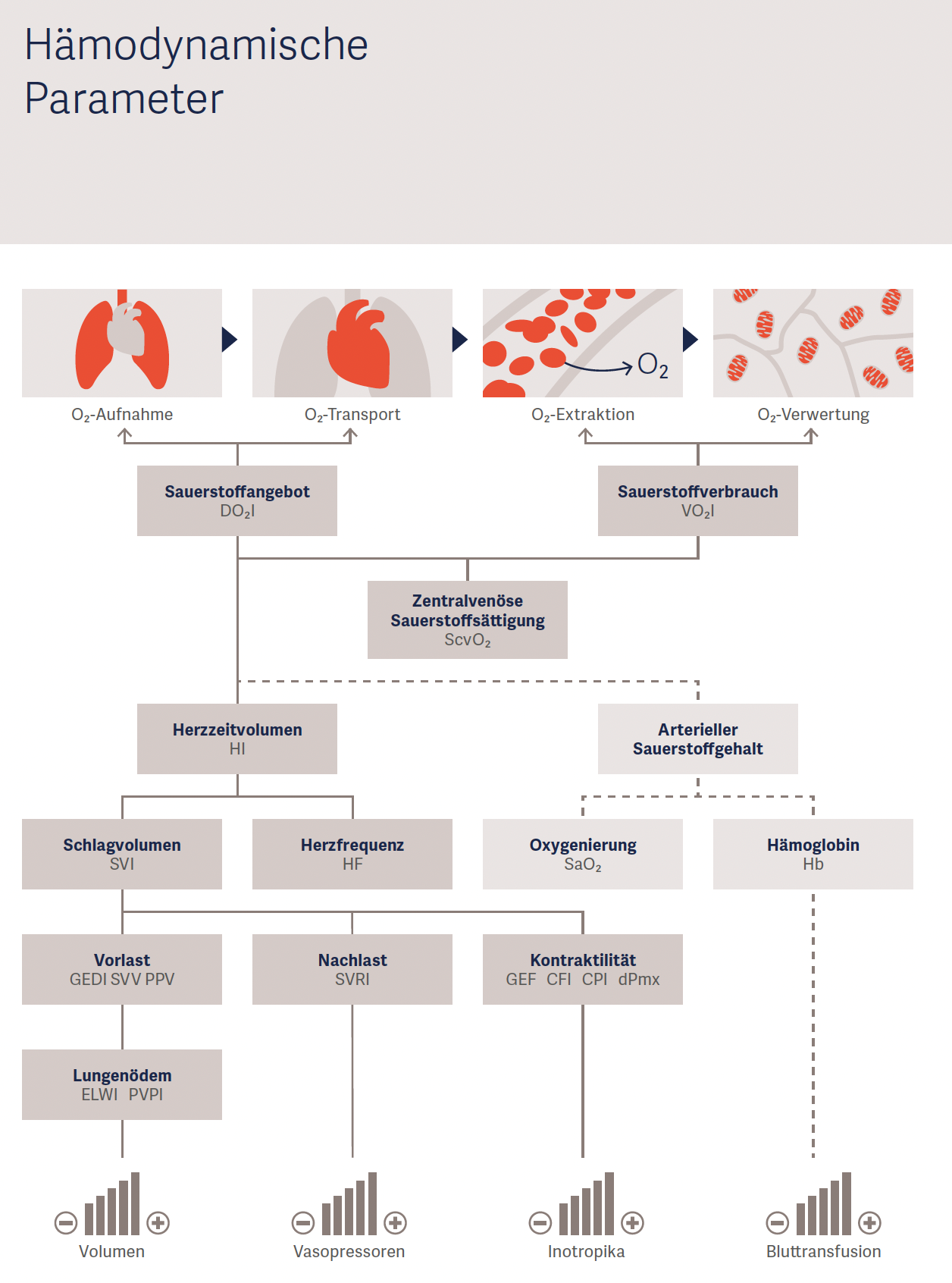
Abbildung 3: Hämodynamische Parameter und ihre Zusammenhänge
Typische Indikationen für den Einsatz des erweiterten hämodynamischen Monitorings sind sowohl in der Intensivmedizin als auch in der Anästhesie:
- Septischer Schock
- Akutes Atemnotsyndrom (ARDS)
- Kardiogener Schock
- Schwere Verbrennungen
- Polytrauma
- Pankreatitis
- Chirurgische Eingriffe mit hohem Risiko
- Zielgerichtete Flüssigkeitstherapie
Mark van Iperen vom Gelderland Valley Hospital in Ede, Niederlande: „Wir nutzen erweitertes hämodynamisches Monitoring bei fast allen Patienten, vor allem bei schwer kranken oder herzkranken Patienten. Die Überwachung physiologischer Parameter ist für das zielgerichtete Management von Intensivpatienten unerlässlich.“
Die Prinzipien der transpulmonalen Thermodilution und die arteriellen Pulskonturanalyse ermöglichen die Berechnung dieser erweiterten hämodynamischen Parameter und sind bereits seit mehr als 20 Jahren klinisch erprobt und etabliert[8],[9].
